TÓM TẮT
Thủy phân sụn chân gà bằng enzyme protease tạo ra dịch trích ly giầu CS nhưng để thu nhận chế phẩm CS đòi hỏi có các phương pháp lọc và sấy thích hợp. Trên cơ sở so sánh hai phương pháp lọc tiếp tuyến qua màng vi lọc (MF) và lọc tiếp tuyến qua màng siêu lọc (UF), đã xác định được phương pháp lọc UF với màng lọc có trọng lượng phân tử cắt bằng 8 kDA hoặc 10 kDA là thích hợp nhất cho quá trình loại bỏ các loại tạp chất để thu hồi dịch CS cô đặc từ dịch trích ly sụn chân gà với hệ số cô đặc dịch CS cao (tương ứng là 9,8 và 10,6), có hệ số phân riêng CS lớn (tương ứng đạt 96,7 % và 95,6 %), cũng như hiệu suất thu hồi CS cao (tương ứng đạt 90,8 và 92,6 %). Ngoài ra, cũng đã xác định được phương pháp sấy phun là thích hợp nhất để tạo ra bột chế phẩm CS từ sụn chân gà có hàm lượng CS lớn nhất là 41,8% và có hiệu suất thu hồi CS cao nhất đạt 90,5 %, khi nhiệt độ không khí nóng đầu vào sấy phun là 110 0C và tốc độ cấp dịch bằng 350 ml/h.
Từ khóa: Chondroitin sulfate, sụn chân gà, trích ly CS bằng papain, màng siêu lọc, sấy phun...
MỞ ĐẦU
Chondroitin sulfate (CS) là axit mucopolysaccharide thuộc nhóm glycosaminoglycan (GAG) và phân bố rộng rãi ở người, động vật có vú và động vật không xương sống khác, cũng như một số vi khuẩn. CS đã được ứng dụng chủ yếu trong các lĩnh vực y học, công nghệ sinh học, dược phẩm, dệt may, thực phẩm và mỹ phẩm… CS có nhiều trong các mô sụn cá mập, cá đuối, cá sấu…, nhưng cũng có nhiều trong các loại sụn gia súc, gia cầm như sụn mũi trâu (Sundaresan et al., 2018), sụn khí quản vịt (Vittayanont et al., 2014) và đặc biệt là sụn chân gà (Widyaningsih et al., 2016)… Công nghệ sản xuất CS đã được nghiên cứu từ rất lâu và hiện nay có nhiều cải tiến như sử dụng enzyme trong quá trình trích ly để làm tăng hiệu suất thu hồi CS (Widyaningsih et al., 2016), sử dụng các phương pháp lọc màng vi lọc (Microfiltration - MF), siêu lọc (Ultrafiltration - UF), lọc nano và thẩm thấu ngược để thu nhận CS có độ tinh khiết cao (Kim et al., 2012). Nhiều nghiên cứu đã thành công trong việc sử dụng màng UF để thu nhận dịch cô đặc có chứa hàm lượng CS cao từ các nguồn nguyên liệu cá đuối, cá mập và ức gà (Lignot et al, 2003 và Kim et al, 2012).
Trong bài báo này chúng tôi trình bày kết quả nghiên cứu các phương pháp lọc để thu nhận CS từ dịch thủy phân sụn chân gà bằng enzyme papain. Sau đó, xác định phương pháp sấy thích hợp cho quá trình tạo chế phẩm CS dạng bột, phục vụ cho quá trình bào chế các loại thực phẩm chức năng như viên nén và viên nang… có tác dụng hỗ trợ phục hồi sụn khớp.
VẬT LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU
Nguyên liệu, hóa chất và thiết bị
Chân gà công nghiệp Việt Nam. Chế phẩm enzyme thương mại papain của SCIYU Biotech (Trung Quốc). Chất chuẩn CS của Banner Pharmacaps (Ấn độ). Methylene blue của Qualigens fine chemicals (Ấn Độ). Các loại màng lọc MF 0,1; 0,2 và 0,45 µm và UF Hollow Fiber Cartridge Model UFP-10-E-3MA Type 3.000; 8.000; 10.000 và 30.000 NMWC của GE Healthcare Life Sciences (Mỹ). Máy lọc màng tiếp tuyến QuixStand™ Benchtop Systems của GE Healthcare Life Sciences (Mỹ) và máy sấy phun Buchi (Đức).
Chuẩn bị dịch chiết giầu CS từ sụn chân gà
Thủy phân bột sụn chân gà bằng chế phẩm enzyme thương mại papain của SCIYU Biotech (Trung Quốc) như sau: tỷ lệ sụn : nước là 1:6w/v, tỷ lệ enzyme là 0,8%w/w, nhiệt độ thủy phân 60 0C, thời gian 12 h. Kết thúc thủy phân, tiến hành nâng nhiệt lên 95 0C trong 15 phút để diệt enzyme, và sau đó tiến hành ly tâm 10.000 vòng/30 phút, nhiệt độ phòng để tách cặn và thu hồi dịch chiết giầu CS từ sụn chân gà (Trương et al., 2020).
Các phương pháp lọc tiếp tuyến qua màng MF và UF dịch CS thủy phân từ sụn chân gà
Phương pháp vi lọc sử dụng màng MF có kích thước lỗ lọc là 0,1; 0,2 và 0,45 µm. Phương pháp siêu lọc sử dụng các loại màng UF có trọng lượng phân tử cắt lần lượt bằng 3; 8; 10 và 30 kDA. Dịch thủy phân CS từ sụn chân gà được lọc tiếp tuyến qua màng MF hoặc UF, kết thúc lọc thu được dịch CS cô đặc không đi qua màng và dịch lọc qua màng có hàm lượng CS thấp hơn so với dịch thủy phân CS trước khi lọc. Tiến hành đo thể tích và xác định hàm lượng CS trong các loại dịch thu được để tính toán các thông số của các quá trình lọc CS.
Các phương pháp sấy tạo chế phẩm CS
Dịch CS cô đặc trên màng được sấy khô bằng 3 phương pháp: sấy đối lưu ở 60 0C; sấy hồng ngoại ở 105 0C và sấy phun với nhiệt độ khí nóng 110 0C và tốc độ cấp dịch 350 ml/h.
Các phương pháp phân tích và xử lý số liệu
Hàm lượng CS được xác định theo phương pháp của Somashekar và cộng sự (2011) dựa trên phản ứng của phân tử CS và xanh methylene. Xác định độ ẩm của các chế phẩm CS bằng phương pháp sấy khô tới khối lượng không đổi ở 105 0C (theo AOAC 927.05). Tính toán các thông số của các quá trình lọc dịch CS và sấy tạo chế phẩm CS được thực hiện theo các công thức dưới đây:
- Hệ số cô đặc dịch CS = V0 / V¬L¬ (1). Trong đó: V0 là thể tích (lít) dịch CS đưa vào lọc và VL là thể tích (lít) dịch CS cô đặc thu được sau khi lọc.
- Độ phân riêng CS (%) = 100 x (C0 – C¬L) / C0 (2). Trong đó: C0 là nồng độ CS (g/l) trong dịch đưa vào lọc và CL là nồng độ CS (g/l) trong dịch qua màng lọc.
- Hiệu suất thu hồi (HSTH) CS sau khi lọc (%) = 100 x MC/M¬0¬ (3). Trong đó: MC là khối lượng CS (g) trong dịch cô đặc không qua màng và M0 là khối lượng CS (g) đưa vào lọc.
- Hiệu suất thu hồi CS sau khi sấy (%) = 100 x MS/M¬0¬ (4). Trong đó: MCP khối lượng CS (g) trong chế phẩm sau khi sấy và M0 là khối lượng CS (g) đưa vào sấy.
Các giá trị là trung bình của ba lần thí nghiệm. Phân tích độ lệch chuẩn (ANOVA) được thực hiện bằng phần mềm SPSS 18.0.
KẾT QUẢ VÀ THẢO LUẬN
Nghiên cứu phương pháp lọc tiếp tuyến qua màng vi lọc và siêu lọc để thu hồi dịch chiết giầu CS từ sụn chân gà
Ảnh hưởng của các phương pháp vi lọc MF đến thông số của quá trình lọc dịch CS
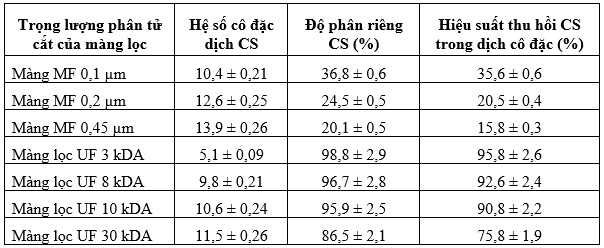
Các kết quả được trình bày ở bảng 1 cho thấy các phương pháp vi lọc qua màng MF có kích thước lỗ lọc tăng dần từ 0,1 µm lên 0,2 µm và đến 0,45 µm có hệ số cô đặc dịch CS tăng dần từ 10,4 lên 12,6 và đến 13,9, tương ứng. Ngược lại, khi kích thước lỗ lọc của màng MF tăng từ 0,1 µm lên 0,45 µm thì độ phân riêng CS giảm từ 36,8 % xuống còn 20,1 %, tương ứng), do kích thước lỗ lọc càng lớn thì càng nhiều CS đi qua màng MF. Tương tự, khi kích thước lỗ lọc tăng dần từ 0,1 µm lên 0,2 µm và đến 0,45 µm thì tỷ lệ CS trong dịch lọc qua màng cũng tăng dần từ 56,5 % lên 76,8 % và đến 81,8 %, tương ứng. Ngược lại, tỷ lệ CS trong dịch cô đặc lại giảm dần từ 35,6 % xuống còn 15,8 %, khi kích thước lỗ lọc tăng dần từ 0,1 µm lên 0,45 µm, tương ứng.
Bảng 1. Ảnh hưởng của các phương pháp UF đến thông số của quá trình lọc dịch CS.
Ảnh hưởng của các phương pháp siêu lọc UF đến thông số của quá trình lọc dịch CS
Các kết quả được trình bày ở bảng 1 cho thấy hệ số cô đặc dịch CS của màng lọc 3 kDA là thấp nhất chỉ bằng 5,1, thấp hơn gần 2 lần so với các giá trị này của cả 3 loại màng còn lại, có các giá trị từ 9,8 đến 11,5. Tuy nhiên, màng UF 3 kDA lại có khả năng giữ lại các phân tử CS cao nhất (có độ phân riêng đạt 98,8 %), do có kích thước lỗ lọc nhỏ nhất. Màng UF 8 kDA và 10 kDA cũng có độ phân riêng rất cao, tương ứng là 96,7 và 95,9 %, lớn hơn đáng kể so với loại màng UF 30 kDA chỉ là 86,5 %. Điều này có nghĩa là các loại màng UF 8 và 10 kDA có khả năng giữ lại nhiều phân tử CS trên màng hơn so với loại màng UF 30 kDA.
Kết quả được trình bày ở bảng 1 cũng cho thấy hiệu suất thu hồi CS của màng UF 3 kDA là lớn nhất đạt 95,8 %. Trong khi đó, chỉ số này của màng UF 30 kDA có giá trị thấp nhất là 75,8 %. Hiệu suất thu hồi CS của màng lọc UF 8 kDA và 10 kDA đạt cũng rất cao, tương ứng là 92,6 % và 90,8%. Từ các kết quả thu được ở trên có thể thấy rằng có từ 91% đến 93% các phân tử CS từ sụn chân gà có trọng lượng phân tử cắt trong khoảng từ 3-30 kDA. Sundaresan và cộng sự (2018) đã xác định được trọng lượng phân từ của CS sụn khí quản trâu là từ 5-20 kDA. Lignot và cộng sự (2003) cho thấy trong các loại màng có kích thước lỗ lọc khác nhau, màng UF 100 nm là thích hợp nhất để thu hồi dịch CS cô đặc sụn cá đuối hoặc theo Murado và cộng sự (2010), màng lọc UF 10 kDA cho hiệu suất thu hồi CS từ dịch thủy phân sụn cá đuối cao nhất là 95,9%. Chính vì vậy, các loại màng UF 8 kDA hoặc 10 kDA sẽ được chọn sử dụng để lọc thu hồi dịch CS cô đặc do đồng thời có hệ số cô đặc dịch CS và độ phân riêng CS cao, cũng như hiệu suất thu hồi CS lớn.
Xác định phương pháp sấy thích hợp để tạo bột chế phẩm CS từ sụn chân gà
Bảng 2. Ảnh hưởng của các phương pháp sấy tới HSTH chất lượng chế phẩm CS
Các kết quả được trình bày ở bảng 2 cho thấy phương pháp sấy phun cho bột CS có mầu trắng, tơi và mịn và cho hiệu suất thu hồi (HSTH) CS đạt giá trị lớn nhất là 90,5%. Các kết quả được trình bày ở bảng 2 còn cho thấy phương pháp sấy phun cho sản phẩm bột CS có hàm lượng CS lớn nhất là 41,8% và độ ẩm thấp nhất là 4,2%. Trước đây, cũng đã có nhiều nghiên cứu sử dụng phương pháp sấy phun để tạo bột CS. Chẳng hạn như, Tadashi (2006) đã sử dụng phương pháp sấy phun để tạo ra bột CS từ dịch trích ly sụn cá hồi.
Kết luận
Đối với dịch thủy phân CS từ sụn chân gà, phương pháp lọc tiếp tuyến qua màng UF tỏ ra ưu việt hơn qua màng MF, do có độ phân riêng CS cao và hiệu suất thu hồi CS lớn hơn. Phương pháp lọc tiếp tuyến sử dụng các loại màng UF 8 kDA hoặc 10 kDA cho dịch CS có hệ số cô đặc cao tương ứng là 9,8 và 10,6 và có độ phân riêng CS lớn tương ứng đạt 96,7 % và 95,9 %, cũng như có hiệu suất thu hồi CS lớn đạt 90,8 % và 92,6 %, tương ứng. Sấy phun là thích hợp hơn sấy đối lưu và sấy hồng ngoại để tạo ra bột CS khô có hàm lượng CS cao nhất là 41,8 % và có hiệu suất thu hồi CS lớn nhất đạt 90,5 %, ở điều kiện nhiệt độ không khí nóng đầu vào sấy phun bằng 110 0C và tốc độ cấp dịch bằng 350 ml/h.
TÀI LIỆU THAM KHẢO
1. Garnjanagoonchorn W, Wongekalak L, Engkagul A, 2007, Determination of chondroitin sulfate from different sources of cartilage, Chem. Eng. Proc., 46: 465–471.
2. Widyaningsih T.D, Rukmi W.D, Sofia E, Wijayanti S.D and Nangin D, 2016, Extraction of Glycosaminoglycans Containing Glucosamine and Chondroitin Sulfate from Chicken Claw Cartilage, Research Journal of Life Science, 3(3): 181-189.
3. Vittayanont M and Jaroenviriyapap T, 2014, Production of crude chondroitin sulfate from duck trachea, International Food Research Journal, 21(2): 791-797.
4. Somashekar P.L, Tripathy A.S, Sathish K.P, Chandrashekar J and Palakshi G.O, 2011, Colorimetric estimation of chondroitin sulfate in bulk drug and pharmaceutical formulation using cationic dye methylene blue, Der Pharma Chem., 3: 90–96.
5. Sundaresan G, Robinson A.J, Appa R.V and Mahantesh M.F, 2018, Established method of chondroitin sulphate extraction from buffalo (Bubalus bubalis) cartilages and its identification by FTIR, J. Food Sci. Technol., 55(9):3439–3445.
6. Lignot B, Lahogue V, Bourseau P, 2003, Enzymatic extraction of chondroitin sulfate from skate cartilage and concentration-desalting by ultrafiltration, Journal of Biotechnology, 103(3): 281-284.
7. Murado M.A, Fraguas J, Montemayor M.I, Vázquez J.A, González P, 2010. Preparation of highly purified chondroitin sulphate from skate (Raja clavata) cartilage by-products. Process optimization including a new procedure of alkaline hydroalcoholic hydrolysis. Biochem. Eng. J., 49, 126–132.
8. Kim S.B, Ji C.I, Woo J.W, Do J.R and Lee Y.B, 2012. Simplified purification of chondroitin sulphate from scapular cartilage of shortfin mako shark (Isurus oxyrinchus). Int J Food Sci Technol., 47(1): 91–9.
9. Trương Hương Lan, Lại Quốc Phong, Phạm Đức Thuận, Đặng Trần Hoàng và Phạm Thị Lê Hương, 2020, Nghiên cứu sử dụng enzyme hỗ trợ quá trình trích ly Chondroitin Sulfate từ sụn khớp chân gà, Bản tin KHCN ngành Công Thương số 6.
10. Tadashi E, 2006, Sodium Chondroitin Sulfate, Chondroitin-Sulfate-Containing Material and Processes for Producing the Same. U.S. Patent Appl., 20,060,014,256.
Lời cảm ơn: Chúng tôi xin trân trọng cảm ơn Bộ Công thương đã cấp kinh phí để thực hiện nghiên cứu này, trong khuôn khổ của Đề tài ‘‘Nghiên cứu sản xuất chế phẩm và thực phẩm chức năng giàu Glucosamine và Chondroitin sulfate (CS) từ phụ phẩm của quá trình chế biến gia cầm’’, mã số ĐT.04.19/CNSHCB.
Study on filtration and drying methods to produce Chondoitin sulfate preparation from chicken feet cartillage Đang Tran Hoang*, Pham Duc Thuan, Truong Huong Lan và Lai Quoc Phong. * Corresponding Author: hoangvnu@gmail.com SUMMARY Hydrolysis of chicken feet cartilage with protease enzyme produces CS rich extracts. However, to obtain CS preparation requires the appropriate filtration and drying methods. Base on the comparation of the two different methods of tangent filtration through microfiltration (MF) membranes and tangent filtration through ultrafiltration (UF) membranes, the UF method with a normal molecular weight cut-off of 8 kDA or 10 kDA has been determined to be the most suitable for the process of removing impurities to recover concentrated CS retentate from the chicken feet cartilage extract, having high volume concentration ratio of CS (9.8 and 10.6, respectively) and having a hight separate coefficient of CS (96.7 % and 95.6 %, respectively), as well as an important recovery yield of CS (90.8 % and 92.6 %, respectively). In addition, it was determined that the spray-drying method was the most suitable to produce CS powder from chicken feet cartilage with the largest CS content of 41.8 % and the highest CS recovery yield at 90,5 %, when the inlet hot air temperature of spray-drying is 110 0C and the material feeding rate is 350 ml/h. Key words: Chondroitin sulfate, chicken feet cartilage, CS extraction by papain, ultrafiltration, spray-drying… |
Đặng Trần Hoàng*, Phạm Đức Thuận, Trương Hương Lan và Lại Quốc Phong
*Liên hệ tác giả: hoangvnu@gmail.com
 Đăng nhập
Đăng nhập